A hidrazina (N2H4) é um composto nitrogenado empregado como combustível de foguetes. Sua produção industrial é feita por meio do processo Raschig, em uma sequência de reações representadas nas equações balanceadas a seguir.
2NaOH (aq) + Cℓ2 (g) → NaCℓO (aq) + NaCℓ (aq) + H2O (ℓ)
NaCℓO (aq) + NH3 (g) → NH2Cℓ (g) + NaOH (aq)
NH2Cℓ (g) + NaOH (aq) + NH3 (g) → N2H4 (ℓ) + NaCℓ (aq) + H2O (ℓ)
a) Escreva a fórmula estrutural da hidrazina. Classifique o tipo de ligação química dos átomos de hidrogênio dessa molécula.
b) Apresente a equação balanceada da reação global do processo Raschig para a produção de hidrazina. Calcule a quantidade mínima de gás cloro, em mols, para a produção de 640 kg de hidrazina nesse processo.
a) 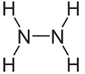 . Nessa molécula, os hidrogênios estão ligados ao nitrogênio por meio de ligação covalente.
. Nessa molécula, os hidrogênios estão ligados ao nitrogênio por meio de ligação covalente.
b) Ao somar as três equações, tem-se: