O benzoato de sódio (C6H5COONa) é um sal orgânico largamente empregado como conservante na indústria alimentícia. Quando dissolvido em água destilada, o íon benzoato sofre hidrólise, produzindo o ácido benzoico conforme a equação a seguir:
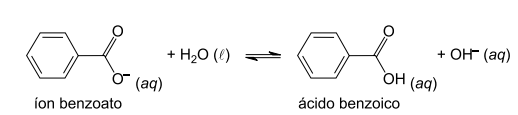
a) Equacione a reação que representa a dissociação aquosa do benzoato de sódio. Explique o que ocorre com a concentração de ácido benzoico no equilíbrio quando se adicionam gotas de ácido clorídrico à solução aquosa de benzoato de sódio.
b) Considerando a constante de hidrólise (Kh) do íon benzoato igual a 2,0 × 10–10 (a 25 ºC) e considerando o produto iônico da água (Kw) igual a 1,0 × 10–14 (a 25 ºC), calcule o pH de uma solução aquosa de benzoato de sódio de concentração 0,5 mol ⋅ L–1, a 25 ºC.
a)
A concentração do ácido benzoico aumentará.
Ocorrerá o consumo dos íons hidroxila formados nessa hidrólise ao se adicionar HCℓ no equilíbrio de hidrólise fornecido:
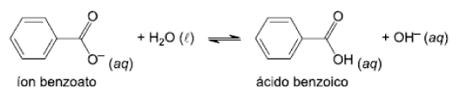
A diminuição da concentração de OH- provoca, de acordo com o princípio de Le Chatelier, um deslocamento nesse equilíbrio para a direita o que faz com que a concentração do ácido benzoico aumente.
b)
pOH = 5 e, portanto,
pH = 9.