Considere o fluxograma do processo mais comum de obtenção do tungstênio a partir do mineral scheelita (CaWO4).
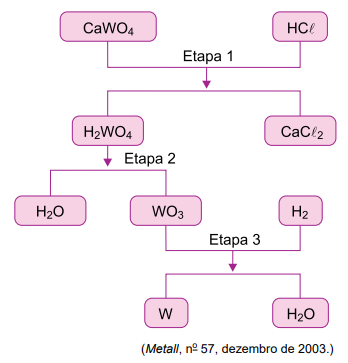
a) Determine o número de oxidação do tungstênio no WO3. Em qual etapa do processo de obtenção do tungstênio a partir da scheelita ocorre um processo de óxido-redução?
b) Escreva a equação balanceada da reação que ocorre na etapa 1. Calcule a massa mínima de scheelita, em quilogramas, necessária para a obtenção de 69 kg de tungstênio metálico, considerando um rendimento de reação de 75%.
a) Cálculo para determinar o número de oxidação do tungstênio.
Portanto, o número de oxidação do tungstênio é +6.
A reação de oxirredução ocorre na etapa 3, pois o tungstênio sofre uma redução (NOX varia de +6, no WO3, para zero, no W), e o hidrogênio sofre uma oxidação (NOX varia de zero, no H2, para +1, no H2O).
b) Equação balanceada da etapa 1:
Massas molares em g/mol: CaWO4 = 288 e W = 184
Para calcular a massa mínima de scheelita (CaWO4) para produzir 69 kg de tungstênio (W), precisamos determinar a quantidade de tungstênio produzida para um rendimento de 100%.
Aplicando a regra de três, temos:
m = 92 kg de tungstênio.
Precisamos montar a equação global para determinar a relação entre o CaWO4 e o W.
A partir da equação global, temos a seguinte relação:
Aplicando a regra de três, temos: