O ácido sulfúrico está entre as principais matérias-primas para a indústria química, e uma das etapas de sua produção envolve a conversão de dióxido de enxofre (SO2) a trióxido de enxofre (SO3), segundo a reação:
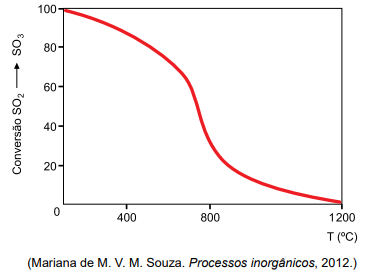
O gráfico que se segue mostra a variação do rendimento dessa conversão em função da temperatura.
a) Escreva a expressão da constante de equilíbrio Kc da reação entre dióxido de enxofre e oxigênio molecular formando trióxido de enxofre numa dada temperatura. Escreva a equação balanceada da reação que representa a obtenção de ácido sulfúrico a partir da reação entre trióxido de enxofre e água.
b) Com base no gráfico de rendimento da conversão de SO2 em SO3 em função da temperatura e no princípio de Le Châtelier, determine se essa reação é exotérmica ou endotérmica. Com base no princípio de Le Châtelier, informe o efeito que um aumento da pressão exercida sobre o sistema químico inicialmente em equilíbrio terá sobre o rendimento de SO3 formado quando for estabelecido o novo equilíbrio.
a) A partir da equação química fornecida, a expressão da constante de equilíbrio pode ser escrita do seguinte modo:
A equação balanceada da reação pedida corresponde à:
b) A partir da análise do gráfico, pode-se concluir que a reação é exotérmica, uma vez que o aumento da temperatura diminui o rendimento da conversão do dióxido de enxofre em trióxido de enxofre. Pelo princípio de Le Chatelier, um aumento da temperatura provoca um deslocamento do equilíbrio no sentido dos reagentes.
Pelo princípio de Le Chatelier, o aumento da pressão provoca um deslocamento do equilíbrio no sentido de formação do menor número de mol de gases. No caso do equilíbrio estabelecido, para o balanceamento apresentado, tem-se que 1,5 mol de gases nos reagentes (SO2 + O2) convertem-se em 1 mol de gás nos produtos (SO3). Assim, um aumento da pressão, mantida a temperatura constante, irá provocar um deslocamento de equilíbrio no sentido de formação de mais produtos, aumentando o rendimento em relação à formação do SO3 .