O oxalato de cálcio em humanos está associado a calcificações benignas do tecido mamário e a pedras nos rins. Em indivíduos saudáveis, a urina é tipicamente supersaturada em oxalato de cálcio. O desenvolvimento de pedras nos rins, por outro lado, é prevenido por proteínas e pequenas moléculas contendo grupos carboxilatos.
a) Considerando o que se informa no texto, escreva uma equação química e a expressão da constante de equilíbrio associada, que representam a formação da pedra no rim. O texto informa que a urina é supersaturada em oxalato de cálcio; o que isso significa conceitualmente, isto é, do ponto de vista do equilíbrio químico?
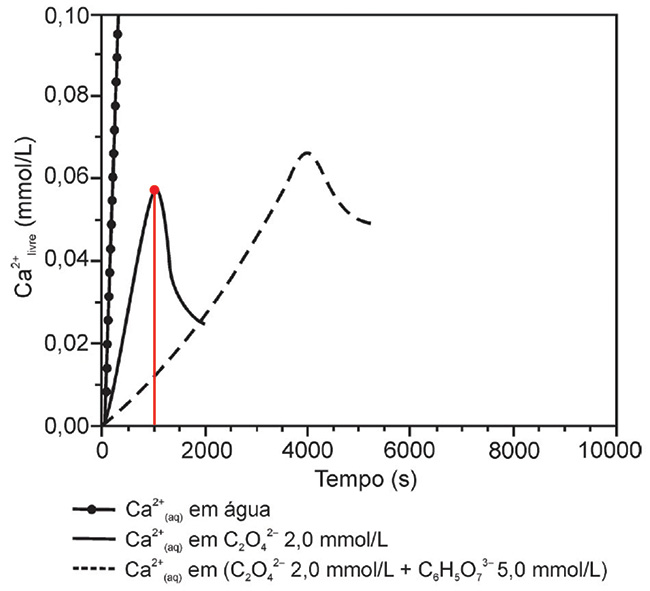
b) Pesquisadores avaliaram como a concentração de cálcio livre (Ca2+) em solução varia quando se adiciona Ca2+(aq) em soluções contendo oxalato de concentração 2 mmol/L e diferentes concentrações de citrato, conforme a figura. Os dados permitem inferir que o citrato pode ser um agente terapêutico na prevenção de pedra no rim. Faça uma descrição quantitativa de modo a justificar, do ponto de vista do equilíbrio químico, a afirmação sobre a função do citrato na prevenção de pedra no rim.
Dados: Oxalato: C2O42−; citrato: C6H5O73−.
a) A equação química que representa a formação de pedras nos rins é:
E a expressão da constante de equilíbrio associada, em função das concentrações (Keq), corresponde a:
Ou, ainda, por meio do seu equilíbrio de solubilidade:
O fato de a urina ser supersaturada em oxalato de cálcio significa que ela, em indivíduos saudáveis, é uma mistura homogênea (solução), na qual o produto das concentrações dos íons cálcio e oxalato é superior à constante do produto de solubilidade (Kps) do oxalato de cálcio nas condições dadas, embora não haja precipitação do sal. Matematicamente, relacionando com expressão representada anteriormente, temos:
E, portanto, na condição de supersaturação:
b) A partir da análise do gráfico, considerando t = 1000 s, pode-se notar que, na presença do citrato, a concentração de íons cálcio livre (0,01 mmol/L) é inferior quando comparada ao sistema em que há somente oxalato (aproximadamente 0,06 mmol/L). Desse modo, é possível inferir que a presença do íon citrato dificulta a precipitação de oxalato de cálcio, assim, o íon citrato atua como um sequestrador dos íons cálcio, sendo necessária, na presença do citrato, maiores concentrações de cálcio, para que ocorra precipitação do oxalato, pelo princípio de Le Chatelier.