Em Química, o termo “metal de sacrifício” refere-se a um metal que é utilizado para proteger outro metal contra a corrosão. Essa proteção é alcançada por meio de um processo chamado proteção catódica, na qual o metal de sacrifício é conectado eletricamente ao metal que se quer proteger, sofrendo corrosão no lugar do metal a ser protegido.
Considere uma situação em que seja necessário proteger da corrosão um encanamento de ferro enterrado em solo ácido, e que estejam disponíveis placas dos metais ouro, prata e magnésio para eventual utilização como metais de sacrifício. Na tabela a seguir são fornecidos os valores dos potenciais padrão de redução dos pares redox que podem eventualmente estar envolvidos na proteção catódica desse encanamento.
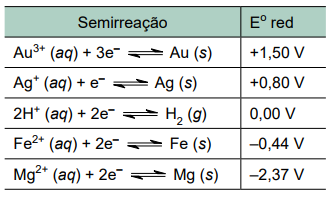
a) Explique qual dos metais disponíveis é o mais eficaz para ser utilizado como metal de sacrifício para proteger o encanamento de ferro da corrosão devido à acidez do solo.
b) Escreva a equação global balanceada da reação de corrosão que ocorre entre o metal de sacrifício escolhido e o ácido proveniente do solo. Calcule a diferença de potencial total envolvida nessa reação.
a) Para que o ferro não se oxide (metal a ser protegido), o metal de sacrifício deve se oxidar no lugar dele, ou seja, o metal de sacrifício deve ter menor potencial de oxidação, ou menor de redução que o do ferro. Dentre os metais constantes na tabela, o único que satisfaz a essa condição é o magnésio.
b) Na reação citada, o magnésio irá se oxidar enquanto o hidrogênio (do solo) se reduz.
A equação global dessa reação é dada por: