Os gases atmosféricos poluentes, resultantes da queima de combustível fóssil, realizam reações secundárias gerando diversos produtos. A reação entre dois desses gases, representada pela equação a seguir, teve a sua cinética estudada a 20 ºC.
NO2(g) → + O3 (g) NO3 (g) + O2 (g)
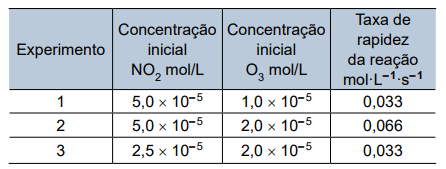
Os dados dos experimentos desse estudo estão apresentados na tabela.
Considere que a equação da rapidez dessa reação, v, seja representada pela equação:
A ordem global dessa reação dada pela soma dos valores de x e y é igual a
De acordo com tabela, nota-se que, ao comparar os experimentos 1 e 2, temos:
- Ao se dobrar apenas a concentração do O3, a velocidade da reação dobra, ou seja, é de primeira ordem para o ozônio e, portanto, y = 1.
Ainda consultando a tabela, nota-se que, ao comparar os experimentos 3 e 2, temos:
- Ao se dobrar apenas a concentração do NO2, a velocidade da reação também dobra, ou seja, é também de primeira ordem para o dióxido de nitrogênio e, portanto, x = 1.
Como a ordem da reação é a soma x + y, conclui-se que essa reação apresenta ordem global igual a 2.