O ácido barbitúrico, C4H4N2O3, é um ácido fraco, com constante de ionização Ka = 1,0 × 10–5. A sua dissociação em água é representada de acordo com a equação:
![]()
A síntese do ácido barbitúrico é feita em laboratório a partir da reação entre a ureia e o ácido malônico. A fórmula estrutural do ácido malônico é apresentada na figura.
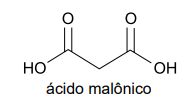
a) Escreva a fórmula molecular do ácido malônico. Classifique esse ácido quanto ao seu número de átomos de hidrogênio ionizáveis.
b) Calcule a concentração de íons H+ presentes em uma solução aquosa de ácido barbitúrico 0,1 mol/L. Determine o pH dessa solução.
a) A fórmula molecular do ácido malônico é C3H4O4.
Esse ácido é classificado como um diácido por apresentar dois grupos ácidos carboxílicos.
b) De acordo com o equilíbrio de ionização e a constante fornecida, para uma solução 0,1 mol/L, temos:
, ou seja, o pH dessa solução é igual a 3.