Certa massa de gás ideal sofreu a transformação PQ mostrada no gráfico.
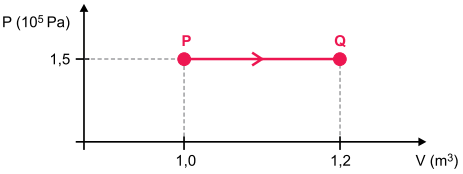
a) Sabendo que no estado P a temperatura do gás era de 300 K, calcule a temperatura do gás, em graus Celsius, no estado Q.
b) Sabendo que nessa transformação a energia interna do gás aumentou em 4,5 × 104 J, calcule a quantidade de calor, em joules, absorvida pelo gás, entre os estados P e Q.
a) De P para Q, por se tratar de uma transformação isobárica, a temperatura do gás, em Kelvin, é diretamente proporcional ao volume ocupado por ele. Como o volume aumentou 20% (de 1,0 para 1,2 m3), conclui-se que a temperatura também aumentou 20%, ou seja, de 300 K para 360 K, que corresponde a 87 oC.
b) Pela primeira lei da Termodinâmica:
Em que
Assim, a quantidade de calor absorvida pelo gás é: