O clorato de potássio (KCℓO3) é um composto termicamente instável. Ao ser aquecido, decompõe-se formando cloreto de potássio sólido (KCℓ) e gás oxigênio (O2).
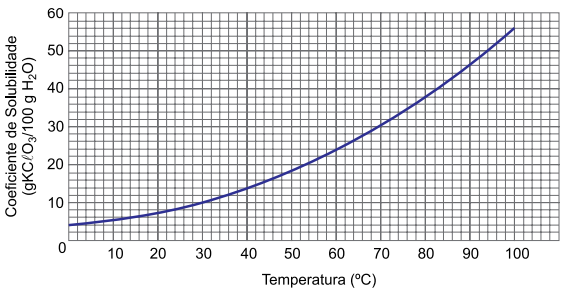
Ao ser misturado com água, o clorato de potássio se dissolve. Sua curva de solubilidade está representada a seguir.
a) Escreva a equação da reação de decomposição térmica balanceada do KCℓO3. Apresente o número de elétrons do cátion potássio.
b) Uma solução foi preparada adicionando-se 24 g de KCℓO3 a 100 g de água a 90 ºC. Essa solução foi resfriada lentamente e mantida em temperatura controlada, a 30 ºC. Em que temperatura iniciou-se a cristalização? Justifique sua resposta por meio do coeficiente de solubilidade. Calcule a massa de KCℓO3 cristalizada na solução mantida a 30 ºC.
a) A equação de decomposição é:
O cátion potássio (19K+) apresenta 18 elétrons.
b)
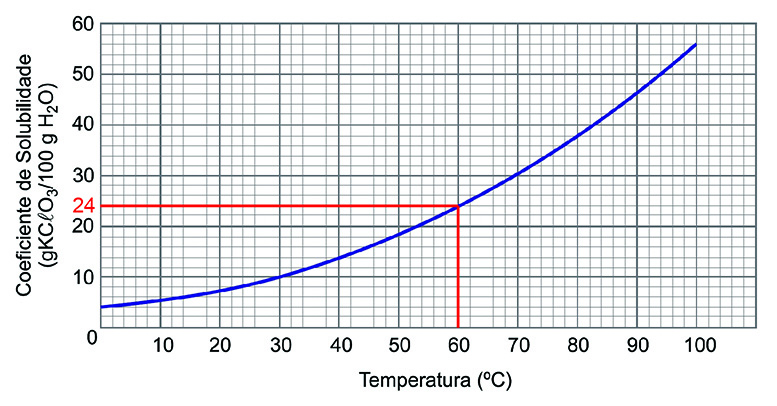
De acordo com o gráfico, a solubilidade do KCℓO3 a 30 °C é igual a 10 g de sal em 100 g de água. A solução foi preparada a 90 °C com 24 g de sal em 100 g de água. Sendo assim, quando o sistema é resfriado a 30 °C, a massa de sal cristalizada é igual a 14 g (24 g – 10 g).